Physique tournée vers le vivant
Confinement
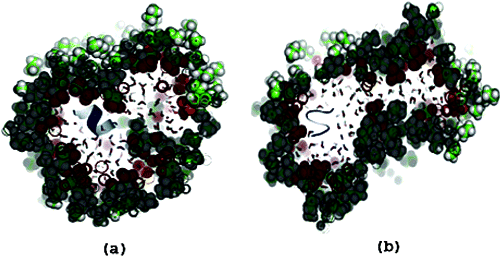 Les simulations de Dynamique Moléculaire ont mis en évidence l'importance du confinement pour le repliement des protéines. Ainsi un peptide, parfaitement replié en hélice alpha dans une micelle inverse de faible rayon, perd sa structure dès que le rayon de la micelle augmente (J. Am. Chem. Soc.; 128(2) p 382 2006).
Les simulations de Dynamique Moléculaire ont mis en évidence l'importance du confinement pour le repliement des protéines. Ainsi un peptide, parfaitement replié en hélice alpha dans une micelle inverse de faible rayon, perd sa structure dès que le rayon de la micelle augmente (J. Am. Chem. Soc.; 128(2) p 382 2006).
Nouvelle méthode pour la caractérisation des interactions entre les protéines insérées dans les bicouches
Nous avons incorporé des protéines dans des bicouches modèles et mesuré leur coefficient de diffusion D. Sa variation nous renseigne sur des interactions possibles entre les inclusions transmembrannaires. 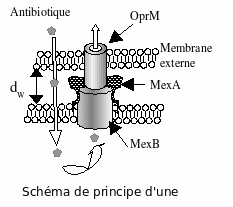 Nous pouvons désormais préciser le mode d'interaction entre deux protéines (dans une même bicouche ou dans des bicouches voisines), la distance à partir de laquelle l'interaction existe, estimer son énergie ainsi que la stoechiométrie. La méthode mise au point, très performante, fournit des informations supplémentaires par rapport à des méthodes plus souvent utilisées comme le Biacore. Contrairement au précédent, elle s'applique aussi aux protéines membranaires. Cette méthode nouvelle a été calibrée par l’étude de l’interaction parfaitement connue entre la streptavidine et des peptides transmembranaires biotinés. Nous avons aussi étudié l’interaction entre deux protéines, MexA et OprM, constitutives d’une pompe à efflux fonctionnant à travers la double membrane de la Pseudomonas Aeruginosa bactérie responsable de plus de 30 % des infections nosocomiales. Nos résultats montrent qu’une interaction entre ces protéines situées dans des bicouches opposées apparaît pour une distance particulière entre deux bicouches, 20 nm, égale à la séparation des deux membranes in vivo. Nous avons également déterminé la variation avec le pH du nombre de MexA accrochées à OprM. Ces résultats sont en accord avec des données cristallographiques. (Soumis (2007))
Nous pouvons désormais préciser le mode d'interaction entre deux protéines (dans une même bicouche ou dans des bicouches voisines), la distance à partir de laquelle l'interaction existe, estimer son énergie ainsi que la stoechiométrie. La méthode mise au point, très performante, fournit des informations supplémentaires par rapport à des méthodes plus souvent utilisées comme le Biacore. Contrairement au précédent, elle s'applique aussi aux protéines membranaires. Cette méthode nouvelle a été calibrée par l’étude de l’interaction parfaitement connue entre la streptavidine et des peptides transmembranaires biotinés. Nous avons aussi étudié l’interaction entre deux protéines, MexA et OprM, constitutives d’une pompe à efflux fonctionnant à travers la double membrane de la Pseudomonas Aeruginosa bactérie responsable de plus de 30 % des infections nosocomiales. Nos résultats montrent qu’une interaction entre ces protéines situées dans des bicouches opposées apparaît pour une distance particulière entre deux bicouches, 20 nm, égale à la séparation des deux membranes in vivo. Nous avons également déterminé la variation avec le pH du nombre de MexA accrochées à OprM. Ces résultats sont en accord avec des données cristallographiques. (Soumis (2007))
"Biomembrane Force Probe" (BFP)
 Le BFP a permis de mesurer les forces nécessaires pour extra ire des peptides transmembranaires. En variant les propriétés des peptides (têtes polaires, hydrophobicité des domaines transmembranaires, etc.) nous avons déterminé les mécanismes d'ancrage de ces objets dans les bicouches. Actuellement nous étudions les aspects énergétiques de l’interaction MexA-OprM.
Le BFP a permis de mesurer les forces nécessaires pour extra ire des peptides transmembranaires. En variant les propriétés des peptides (têtes polaires, hydrophobicité des domaines transmembranaires, etc.) nous avons déterminé les mécanismes d'ancrage de ces objets dans les bicouches. Actuellement nous étudions les aspects énergétiques de l’interaction MexA-OprM.
Moduler les interactions entre les protéines insérées dans les bicouches
 La cristallisation des protéines membranaires reste un défi scientifique d'actualité. Nous avons étudié l'auto - association de peptides et protéines transmembranaires, ainsi que le rôle du mésappariement hydrophobe, dans un système modèle où l'épaisseur de bicouche peut être continûment accrue. Lorsque l'épaisseur de la bicouche dépasse une valeur critique on observe une transition entre une population monomérique et une population de peptides liés en micro- agrégats. Sous certaines conditions, ceci induit une cristallisation des peptides. (Biophys. J. Soumis (2007))
La cristallisation des protéines membranaires reste un défi scientifique d'actualité. Nous avons étudié l'auto - association de peptides et protéines transmembranaires, ainsi que le rôle du mésappariement hydrophobe, dans un système modèle où l'épaisseur de bicouche peut être continûment accrue. Lorsque l'épaisseur de la bicouche dépasse une valeur critique on observe une transition entre une population monomérique et une population de peptides liés en micro- agrégats. Sous certaines conditions, ceci induit une cristallisation des peptides. (Biophys. J. Soumis (2007))
Compressibilité des protéines
 Les mesures des variations de la densité et de la vitesse ultrasonore dans une solution de protéines fournissent des informations sur la variation de leur flexibilité induites par des conditions expérimentales bien choisies. Ainsi la liaison de substrats endogènes ou de médicaments aux protéines de transport contrôle leur flexibilité. Nous mesurons ces changements pour deux vecteurs de médicaments, l'albumine et la β-lactoglobuline. induits par la liaison de tensioactifs. Ces molécules constituent de bons "modèles" pour tester la liaison sur ces protéines de petites molécules de médicaments couramment utilisés comme les anti-inflammatoires non-stéroïdiens. (Biophys. J. 91 (2006) 3397-3404
Les mesures des variations de la densité et de la vitesse ultrasonore dans une solution de protéines fournissent des informations sur la variation de leur flexibilité induites par des conditions expérimentales bien choisies. Ainsi la liaison de substrats endogènes ou de médicaments aux protéines de transport contrôle leur flexibilité. Nous mesurons ces changements pour deux vecteurs de médicaments, l'albumine et la β-lactoglobuline. induits par la liaison de tensioactifs. Ces molécules constituent de bons "modèles" pour tester la liaison sur ces protéines de petites molécules de médicaments couramment utilisés comme les anti-inflammatoires non-stéroïdiens. (Biophys. J. 91 (2006) 3397-3404 ![]() )
)