“Influence du battement du flagelle et de la composition lipidique du spermatozoïde sur l’étape de fusion des gamètes chez le mammifère”.
Abstract :
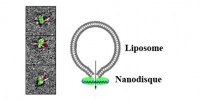
La fécondation est la rencontre de deux gamètes. Bien que centrale chez les espèces sexuées, la chronologie des mécanismes membranaires et moléculaires n’est pas établie de façon précise. Par ailleurs, la communauté scientifique bute toujours sur la question centrale : Comment le spermatozoïde fusionne-t-il avec l’ovule ? Ces 30 dernières années, les efforts ont essentiellement porté sur la détermination d’un couple ligand-récepteur responsable de la fusion des gamètes. Si des études récentes ont permis d’identifier trois protéines essentielles à la fusion : Izumo1 sur le spermatozoïde, Juno (son récepteur) et CD9 sur la membrane de l’ovocyte, elles montrent également que ces protéines ne sont pas suffisantes et que d’autres facteurs sont impliqués. Notre étude avait pour but d’identifier et caractériser des paramètres autres que protéiques impliqués dans la machinerie de fusion gamétique. Nous nous sommes focalisés sur la contribution des lipides spermatiques et sur celle du battement du flagelle lors de l’interaction du spermatozoïde avec l’ovocyte. Pour cette étude, nous avons développé deux méthodes expérimentales originales, opposées dans leurs approches mais parfaitement complémentaires. Avec la première, qualifiée de « Bottom-up », nous avons tenté d’identifier la machinerie spermatique minimale pour induire la fusion avec l’ovocyte. L’idée était de reconstituer pas à pas la membrane de la tête du spermatozoïde sous forme d’une membrane biomimétique composée d’abord des lipides spermatiques identifiés lors des analyses lipidiques des têtes spermatiques, puis en y incorporant la protéine Izumo1. Nous avons analysé les propriétés physico-chimiques des membranes obtenues à chacune de ces étapes et testé leur capacité fusogène en mesurant les énergies d’activation de la fusion de ces systèmes biomimétiques et en étudiant leurs interactions avec des ovocytes. Pour la seconde approche, appelée « Top-down », nous avons développé un outil microfluidique permettant de guider le spermatozoïde à un endroit prédéfini de l’ovocyte et de suivre la rencontre des gamètes avec le « meilleur » point de vue dans des conditions aussi physiologiques que possible. Nous avons ainsi découvert que contrairement à ce qu’on pensait du battement du flagelle, celui-ci ne sert pas seulement à amener le spermatozoïde jusqu’à l’ovocyte, mais il sert aussi à déclencher la fécondation après l’entrée en contact des gamètes, et encore… seulement s’il bat selon un mode bien précis que nous avons caractérisé. Les contraintes mécaniques générées par ce battement déclenchent une réorganisation de la membrane de l’ovocyte incluant la protéine CD9, dont on a établi la cinétique de recrutement dans la zone de contact des gamètes menant à la fusion. Enfin le timing précis de la cascade d’événements aboutissant au mélange des ADN des deux gamètes a été obtenu avec une résolution temporelle inégalée de l’ordre de la minute.